
Mycket har hänt inom medicinen som har förbättrat hälsan för personer med Downs syndrom de senaste decennierna, men fortfarande har man ingen behandling för den intellektuella funktionsnedsättningen eller den ökade risken för Alzheimers sjukdom. I förhållande till hur vanligt det är med Downs syndrom, och vilken stor betydelse det skulle ha att få lättare för inlärning, språk och minne, så är det relativt få forskare som har ägnat sig åt möjligheten att behandla den intellektuella funktionsnedsättningen. Trots det har forskningsfältet börjat få momentum och de aktiva forskarna blir alltmer optimistiska.
Den stora genkartläggningen
Redan på 1980-talet påbörjades planeringen i USA för att kartlägga människans alla gener. 2003 var det klart, efter ett stort internationellt samarbete.
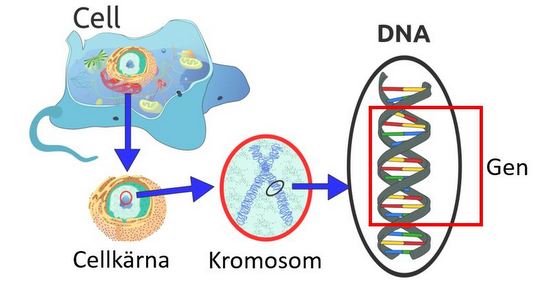
Människan visade sig ha drygt 20.000 gener, vilket var långt mindre än man tidigare trott och i samma storleksordning som t.ex. möss. Kromosom 21 är människans minsta kromosom och den var kartlagd år 2000. Den betecknas kort HSA21 och innehåller cirka 1,5% av människans DNA. Beroende på hur man definierar ”gen” så rapporteras HSA21 ha olika antal gener; en räkning är 223 protein-kodande gener, 174 icke-kodande RNA, 192 pseudo-gener och 10 ’övriga’, totalt 599. En pseudo-gen liknar en kodande gen men är inaktiverad.
Det finns personer som har partiell Trisomi 21, dvs bara en del av kromosom 21 extra. Genom dem kände man sedan länge till att det framförallt är gener från ett visst segment på den långa armen av HSA21 som ger upphov till Downs syndrom, och man kallade det området för ”Down Syndrome Critical Region”. Numera tror man inte att den gränsen är helt absolut. De gener på kromosom 21 som ger upphov till Downs syndrom är gener som är ”dos-känsliga”, där det spelar roll att man får 50% extra. För övriga gener spelar det ingen roll om man har tre eller två. Gener är inte heller aktiva hela tiden; aktiviteten varierar över tid och i olika vävnader. Gener kan påverka varandra ”epigenetiskt”, d.v.s. aktivera eller inaktivera varandra, och gener på HSA21 påverkar också gener på andra kromosomer. Nu fördjupar man kunskapen om Trisomi 21 genom att identifiera alla gener på HSA21 som är doskänsliga, vilka processer de ingår i och vilka egenskaper/effekter de bidrar till.
Musmodeller av Downs syndrom
Cirka 160 av de proteinkodande generna på HSA21 har sina motsvarigheter på tre kromosomer hos möss. De flesta (cirka 100) finns på musens kromosom 16 (MMU16), cirka 40 finns på MMU10 och cirka 20 finns på MMU17. Redan på 1970-talet skapade man och studerade möss med trisomier. Möss som fick en extra uppsättning av hela MMU16 överlevde inte efter födseln. På 1980-talet arbetade Muriel Davisson på Jackson Laboratory med att ta fram en musmodell med extra gener och egenskaper som motsvarade Downs syndrom. Musmodellen som fick en extra uppsättning av det segment på MMU16 som innehåller de flesta ”DS-generna”, visade sig vara både livskraftig och dela många egenskaper med Downs syndrom. Denna musmodell kallas Ts65Dn. Det finns idag många olika modeller av DS-möss som innehåller olika mycket extra ”DS-gener”, men Ts65Dn är den mest använda modellen i de studier där forskare försöker lära sig hur olika gener bidrar till olika egenskaper.

Pre-kliniska försök – in vivo och in vitro
Antalet publicerade studier med ”DS-möss” har ökat under hela 2000-talet. Många studier har testat olika interventioner med syfte att påverka hjärnans utveckling, och ett flertal har också lyckats. De ämnen och doser som använts är många gånger inte aktuella för mänskligt bruk p.g.a. risker för biverkningar, men syftet har varit att undersöka att och hur man kan påverka hjärnans utveckling.
Ts65Dn är den enda musmodellen som hittills använts i prekliniska försök av läkemedels-kandidater för förbättring av inlärning och minne. Bromsmediciner som används för patienter med Alzheimers sjukdom har testats på Ts65Dn-musen och där visat mycket positiva kognitiva effekter. När dessa mediciner testades på människor med Downs syndrom (utan Alzheimer) fick man dock inte samma resultat. Frågan är i vilken grad behandlingseffekter hos Ts65Dn kan förväntas hos personer med Downs syndrom. Ts65Dn har en extra uppsättning av 88 gener som motsvarar HSA21-gener, dvs 55% av de HSA21-motsvarigheter som finns hos musen. Men dessutom har den extra kopior av ett antal gener som inte alls har någon motsvarighet på HSA21. Det är mycket besvärligt och dyrt att ta fram en mus-modell med en extra kopia av alla de ”DS-gener” som finns hos musen, men för en tid sedan gjorde man det. Denna nya modell har korsats fram från möss med extra genkopior från respektive MMU10, MMU16 och MMU17, och kallas Triple Trisomic (TTS). När man nu noggrant undersökt egenskaperna hos TTS-musen så har den överlag en lindrigare grad av kognitiv funktionsnedsättning än Ts65Dn.
Men man gör också studier på mänskliga celler. 2007 lärde man sig att omprogrammera kroppsceller så att de backar till ett stamcellsstadium, s.k. inducerade pluripotenta stamceller (iPSC), och sedan kan man styra vilken sorts cell (nerv, muskel, blod osv) som de skall utvecklas till i en cellodling. I och med detta kan man se vad som händer när cellerna utvecklas och förökar sig, och testa hur de påverkas av olika behandlingar. För att veta om påverkan på en Trisomi 21-cell beror på att den har just en extra kopia av HSA21 så behöver man jämföra med en identisk cell – fast utan extra kromosomer. Forskare i Schweiz har gjort många studier på celler från enäggstvillingar där bara den ena tvillingen har Downs syndrom. Andra forskare använder inducerade pluripotenta stamceller från personer med Trisomi 21 Mosaik.
Kliniska försök
Personer med Downs syndrom har en obalans mellan ”broms och gas” i kontakten mellan nervcellerna, i synapserna. När signalämnet GABA binder till en GABAα-receptor så hämmas nervsignalen. Det pågår kliniska försök med ett par olika ämnen som blockerar GABAα-receptorerna; PTZ är en icke-selektiv antagonist medan RG1662 är en selektiv antagonist som bara blockerar en av sex sorters GABAα-receptorer. Risken med icke-selektiva antagonister är bieffekter som oro och krampanfall, och studien i Australien av PTZ är en Fas1b-studie med en svagare dos för att pröva säkerhet, tolerabilitet, och preliminär effekt hos personer med Downs syndrom i åldern 13-35 år. Roche inledde kliniska studier av GABAα5-receptor antagonisten RG1662 redan 2011. α5-receptorn finns framför allt i hjärnans hippocampus. Den största Fas II-studien (CLEMATIS) med 180 deltagare i tio länder påbörjades i maj 2014 och beräknas nu bli klar med datainsamlingen i maj 2016. Deltagarna är i åldern 12-30 år. Roche har också nyligen påbörjat rekryteringen i USA till en Fas II-studie med deltagare i åldern 6-11 år och den datainsamlingen beräknas vara klar i april 2017.
I Frankrike pågår den kliniska studien ACTHYF, sponsrad av Institut Jerome Lejeune, där små barn med Downs syndrom behandlas ett år med tyreoidea-hormoner och/eller Folinic Acid (som kan agera som folsyra men är lättare för kroppen att ta upp). En tidigare studie av behandling med Folinic Acid visade en positiv effekt på den mentala utvecklingen för de deltagare som (oberoende av studien) behandlades med sköldkörtelhormon samtidigt. Deltagarna i den nu pågående studien är i åldern 6 – 18 månader när de börjar och de behandlas antingen med båda substanserna, endera substansen, eller enbart placebo. Studien startade 2012 och man planerar att 256 barn skall ha deltagit i studien när datainsamlingen avslutas 2017.
I Spanien genomförs Fas II-studien TESDAD av EGCG som finns i grönt te. Pilot-studien visade på positiva kognitiva- och hälsoeffekter, vilka dock försvann när deltagarna slutade med kosttillskottet. I TESDAD kombineras EGCG med kognitiv träning i syfte att uppnå mer bestående förändringar. Man följer också upp EGCG:s hämmande effekt på gener som bidrar till Alzheimer. Den första delen av TESDAD med 84 deltagare i åldern 16-34 år har avslutat datainsamlingen, men resultaten är inte publicerade än. Två ytterligare TESDAD-studier planeras i Spanien, en med deltagare i åldern 6-12 år och en med deltagare i åldern 2-6 år, enligt Institut Jerome Lejeune som sponsrar en del av TESDAD.
På väg mot behandling av Trisomi 21
Forskarna är överens om att ju tidigare man kan behandla hjärnan, desto större effekt får man. Tidig fosterdiagnostik skulle kunna innebära en möjlighet att påverka hjärnans utveckling fundamentalt och undvika funktionsnedsättning. Man vet i princip vad som behöver och kan göras under fosterstadiet, och man ser det som en högt prioriterad uppgift att identifiera tillräckligt effektiva ämnen som är utan biverkningar för både mamman och fostret, samtidigt som de kan passera både moderkakan och blod-hjärnbarriären hos fostret. Hjärnan utvecklas starkt även efter födseln under spädbarnstiden – hjärnbarken som anlagts under fostertiden mognar fortfarande, lillhjärnans nervceller fortsätter att bildas, migrera och mogna till två års ålder och hippocampus ännu längre. Hjärnan mognar under uppväxten, och under hela livet genereras nya nervceller i hippocampus – även om det inte alls är i samma omfattning som under fostertiden. Synapser nyskapas och ”bygger om” hjärnan som en del av vår livslånga anpassning och inlärning.
Behandling med mediciner, rätt kost, stimulerande miljö, god sömn, fysisk aktivitet – allt kan påverka hjärnans funktion och hälsa. Det finns många möjligheter idag att hjälpa hjärnan i alla åldrar att må så bra som möjligt – och det kommer att finnas ännu fler möjligheter imorgon.
Läs mer:
Pharmacological approaches to improving cognitive function in Down syndrome: current status and considerations (2014, Dec: Gardiner KJ) PMID25552901, PMC4277121
Conclusion:
The reproducible rescue of [Learning / Memory] L/M deficits in the Ts65Dn, with a large and diverse panel of drugs, is a valid reason for optimism that effective human clinical trials for cognitive deficits in DS will be possible. That these preclinical evaluations were successful in a broad age range of adult (as well as in pre and perinatal) Ts65Dn mice is of major significance. There are an estimated 300,000 people with DS in the US, thus forming a very significant target treatment population. While prevention of cognitive deficits is an important goal, prenatal treatments come with their own more stringent and challenging requirements for safety demonstrations. The details of the Ts65Dn experiments used in preclinical evaluations are important; different drugs rescued L/M in different tasks, or they produced only partial rescue, with and without attendant rescue of neurogenesis. This suggests that combinations of drugs may be both necessary and advantageous. This approach is common in cancer therapy and viral infections, and recent methods for the rapid identification of optimally effective combinations of drugs could be easily applied to in vitro DS systems. In spite of reasonable cause for optimism, however, the genetic limitations of the Ts65Dn are clear and may have consequences for outcomes of clinical trials. If phenotypic features and drug responses are affected in DS by Hsa21 genes that are not trisomic in the Ts65Dn, as well as by the non-Hsa21 genes that are trisomic, then preclinical evaluations may be less reliable and their effective translation to human clinical trials less successful than outcomes in the Ts65Dn suggest. Solutions to this challenge are not clear. The use of the full trisomy mouse that can be created by crossing the three duplication lines is very expensive, especially when testing of multiple drugs and multiple L/M tasks is the objective. Exploration of drug responses in human, neurally relevant, DS-derived cell lines could complement studies with additional mouse models of DS. Elucidation of the molecular basis of drug responses has received little attention to date, but it could be used to identify features common to successful drugs, leading to potentially more efficacious drug targets.
Timing of therapies for Down syndrome: the sooner, the better. (2015, Oct: Stagni F, Giacomini A, Guidi S, Ciani E, Bartesaghi R.) PMID26500515, PMC4594009
Abstract
Intellectual disability (ID) is the unavoidable hallmark of Down syndrome (DS), with a heavy impact on public health. Accumulating evidence shows that DS is characterized by numerous neurodevelopmental alterations among which the reduction of neurogenesis, dendritic hypotrophy and connectivity alterations appear to play a particularly prominent role. Although the mechanisms whereby gene triplication impairs brain development in DS have not been fully clarified, it is theoretically possible to correct trisomy-dependent defects with targeted pharmacotherapies. This review summarizes what we know about the effects of pharmacotherapies during different life stages in mouse models of DS. Since brain alterations in DS start to be present prenatally, the prenatal period represents an optimum window of opportunity for therapeutic interventions. Importantly, recent studies clearly show that treatment during the prenatal period can rescue overall brain development and behavior and that this effect outlasts treatment cessation. Although late therapies are unlikely to exert drastic changes in the brain, they may have an impact on the hippocampus, a brain region where neurogenesis continues throughout life. Indeed, treatment at adult life stages improves or even rescues hippocampal neurogenesis and connectivity and hippocampal-dependent learning and memory, although the duration of these effects still remains, in the majority of cases, a matter of investigation. The exciting discovery that trisomy-linked brain abnormalities can be prevented with early interventions gives us reason to believe that treatments during pregnancy may rescue brain development in fetuses with DS. For this reason we deem it extremely important to expedite the discovery of additional therapies practicable in humans in order to identify the best treatment/s in terms of efficacy and paucity of side effects. Prompt achievement of this goal is the big challenge for the scientific community of researchers interested in DS.
Building an adaptive brain across development: targets for neurorehabilitation must begin in infancy. (2015, Sep: Edgin JO, Clark CA, Massand E, Karmiloff-Smith A) PMID26441566, PMC4565977
Abstract
Much progress has been made toward behavioral and pharmacological intervention in intellectual disability, which was once thought too difficult to treat. Down syndrome (DS) research has shown rapid advances, and clinical trials are currently underway, with more on the horizon. Here, we review the literature on the emergent profile of cognitive development in DS, emphasizing that treatment approaches must consider how some “end state” impairments, such as language deficits, may develop from early alterations in neural systems beginning in infancy. Specifically, we highlight evidence suggesting that there are pre- and early postnatal alterations in brain structure and function in DS, resulting in disturbed network function across development. We stress that these early alterations are likely amplified by Alzheimer’s disease (AD) progression and poor sleep. Focusing on three network hubs (prefrontal cortex, hippocampus, and cerebellum), we discuss how these regions may relate to evolving deficits in cognitive function in individuals with DS, and to their language profile in particular.
Down Syndrome Cognitive Phenotypes Modeled in Mice Trisomic for All HSA 21 Homologues (2015, Jul: Belichenko PV, Kleschevnikov AM, Becker A, Wagner GE, Lysenko LV, Yu YE, Mobley WC) PMID26230397, PMC4521889
Conclusions
In conclusion, TTS mice exhibited changes in body weight, locomotion and general fitness, deficient working memory and long-term memory, and reduced synaptic plasticity as measured by induction of LTP in the dentate gyrus. Thus many, but not all of the phenotypes described in previous models of DS were detected in TTS mice. This unexpected finding points to complexity of the genotype-phenotype relationship in DS. Indeed, it is likely that some of the phenotypes observed in previous, genetically less complete DS models, may arise from unopposed action of genes, whose effects are counterbalanced in the TTS mice by action of other triplicated genes. A question thus arises: Which of the DS models should be considered as more adequate—models with stronger phenotypes (e.g., Ts65Dn mice) or models most closely replicating genetic changes observed in DS (e.g., TTS mice)? We view the genetic correctness as the most important feature for a genetic model. As such, we point to TTS mice as a new standard by which to compare and guide studies defining genotype-phenotype relationships in DS.
Relaterat på hemsidan:
På väg mot minskad cell-stress (Jun 2021)
Ämne i grönt te hjälper hjärnan (Jan 2015)
Roche avbryter kliniska försök med GABA-hämmare (Jun 2016)
Grönt te-extrakt ger bättre kognitiv och adaptiv förmåga (Aug 2016)

